�g���֘A���i�̌o�܂Ƃ��̉e��
1�j���ѐ���̍g���T�v�������g���߂���o��
2024�N�A���Ԃ𑛂������g���֘A���i�̎�����U��Ԃ��Ă݂܂��傤�B
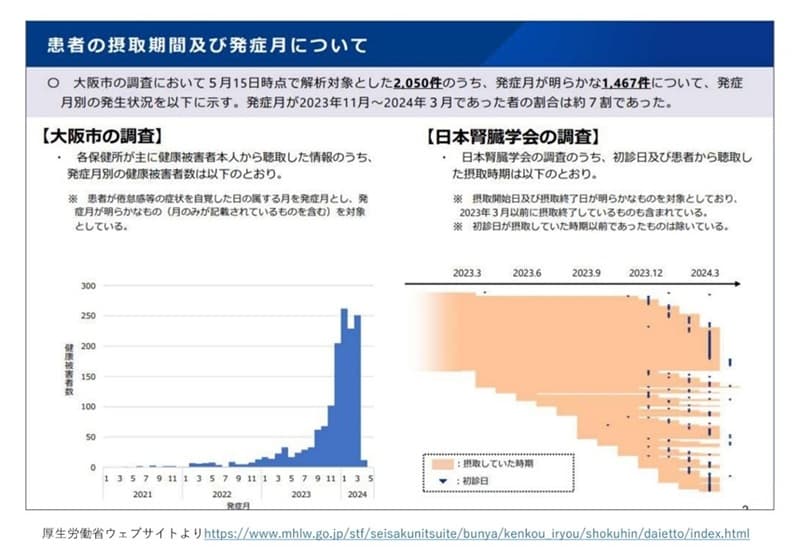
3��22���ɏ��ѐ��L�҉���J���A���Ђ̍g���T�v�������g�œ��@���̌��N��Q�������������Ƃ���֘A3���i�Ɏ������̂��m�点�\�B���N��Q�̈�t����̑����1��15���ɂ������ɂ�������炸�������܂�2�J���ȏォ���������Ƃ����ɂȂ�܂����B
���N��Q���N�������i�ׂ��Ƃ���A�ꕔ�̍g�������Ɂu�Ӑ}���Ȃ������v���܂܂�Ă��邱�Ƃ��������܂����B�܂��A�T�v�������g�ȊO�ɂ��A���Ђ���������g�����ޗ����g�p�������{���A�p���̎���������������n�܂�܂����B3��26���ȍ~�ɂ͓��ЂɎ��S�̕�����A���̌�����������ŏ���҂̕s�����L����܂����B
�������ƂȂ������i�́A�\�����@�ɂ���肪����܂����B���Ƃ��Ε\�ʂɑ傫���u���ʃR���X�e���[���l��������v�uLH���������v�ƒf�����ĕ\�����Ă��܂����A�����̓V�X�e�}�e�B�b�N���r���[�Ɋ�Â��ċ@�\�����u���ꂽ�v���̂ł���̂ɁA���̎|���\������Ă��܂���ł����B���킹�ď��܂̎ʐ^������A���i�̂悤�Ɍ���������҂������Ǝv���܂��B
3��29���A���J�Ȃ��A���������́u�v�x�����_�v�̉\���Ђ��������Ƃ����\����܂����B�v�x�����_�́A�J�r����������J�r�ł̈��ł��B�J�r�������H���̂ǂ����ō����������Ƃ������ł����B
���������Ă���g���֘A���i�͑�p�ȂNJC�O�ɂ��A�o����Ă��܂����B���͍��������ɂƂǂ܂炸�A���{�̐H�̈��S��h�邪�����ł��B�����[���ɎƂ߁A�W�t����c�ł�5�����܂łɌ���������x�̌������̎w�����o����܂����B���킹�Č��J�ȂƑ��s�ɂ��ɂ�鏬�ѐ���̐����H��̗������茟�����s���܂����B
���݂����J�Ȃ̃E�F�u�T�C�g�ł͍��ł����T���N��Q�����Ă��܂��B2025�N2��9�����_��2, 685���A���@552���A���Ґ�404���ƂȂ��Ă��܂��B���̒��ɂ́A�������⒲���s�\�̓��e�������܂܂�Ă���A���Ɏ��Ґ��̒����̓T�v���ێ悪���炩�Ȍ����ƂȂ����̂��͈��ʊW�܂ł͉𖾂ł��Ă��܂���B�����A���ɑ����̕������@����ʉ@�������Ƃ͊m���ł��B
���̌����@�ւŌ���������T���Ă����ƁA�v�x�����_�A���̑��̖��m�̉�����Y�AZ�����o����܂������A��p�@���Ȃǂ̌��͂��ꂩ��ŁA�ڍׂ���������܂łɂ͂܂����Ԃ������肻���ł��B
�Ƃ���ŁA�g���Ō��N��Q�����̂͂ǂ������l�����ł��傤���B���s����{�t���w��̒����ł͏�����7���ȏ���߁A�N��ʂł�60�Έȉ����ߔ������߂Ă��܂��B�Ƃ��ɏ����͍X�N����ɃR���X�e���[���l���オ�茒�N�f�f�ň��������邱�Ƃ�������̂ŁA�a�@�ɍs�����h���b�O�X�g�A�̃T�v�������g�ʼn��Ƃ��������Ƃ��������A�g���T�v�������g��ێ悵���ƍl�����܂��B
���N��Q����������N�������̂��A���{�t���w��̒����������2023�N��9�������肩�珙�X�ɑ����A11�����납��}�����Ă��܂��B�ǂ����V���A�W��������̃��b�g�̐��i�ɖ{���͓����Ă͂����Ȃ����������荞�ƍl�����܂��B
�g���֘A���i��1�N�ȏ����ł���l�̒��ɂ́A����܂ł͉����Ȃ������̂ɁA11���A12�������肩�猒�N��Q��i����悤�ɂȂ��Ă��܂��B�܂��A1���A2�����珉�߂Ĉ��ݎn�߂Č��N��Q�ɂȂ����l�����܂��B���̐l�����́A���ѐ������Ƒ������������Ă���A���N��Q�ɑ���Ȃ�������������܂���B
�����ѐ���̊�ƐӔC
���ѐ����1���ɂ͈�t����̘A���Ō��N��Q��c�����Ă����̂ɁA���������\�܂�2�J���ȏォ�����Ă��܂��܂����B�܂��A�L�҉�ł́u�H��͌������Ǘ����Ă���v�Əq�ׂĂ��܂������A���̌�̑�O�҈ψ���̒����ŁA������Ȑ����Ǘ������炩�ɂȂ�܂����B
���Ƃ��A���H��ōg���̃^���N�̓��W�ɐJ�r�����Ă����ƌ���S���҂��i���Ǘ��S���҂ɕ��Ă����̂ɂ�������炸�A�u���т͂悭�����邱�Ƃ����邩����v�v�ƕi���Ǘ��S���҂��X���[���Ă������Ƃ��킩���Ă��܂��B
�܂��A���Ґ��A���Ґ��ɂ��ĉߏ����������Ƃ����炩�ɂȂ�܂����B
7��23���ɂ͑�\������В��̏��я͍_�����C�B2025�N2���́A2024�N12�������Z�̐�����ł́A���ȗ����̌��v�\�B�{�i�I�ȕ⏞�ɂ��Ă͂܂��x�����͎n�܂��Ă��܂���B���̗��R����Б��́A���Ò��̐l������������Z�肪�ł����A���Ԃ�������Ɛ������Ă��܂��B
���Q�l�܂łɁA�H�i�Y�����⒅�F���Ƃ��āu�x�j�R�E�W�F�f�v���悭�g�p����Ă��܂����A����Ə��ѐ���̍g�������͑S���ʂ��̂ł��B���ѐ���̍g�������͐H�i�����ł���A�T�v������{���A�p���ȂǂɎg�p����Ă��܂����B
�H�i�����ƐH�i�Y�����͍������S���Ⴂ�܂����A�H�i�����͍��̋K�i��͂���܂��H�i�Y�����͍��̋K�i�����������߂��Ă��܂��B�x�j�R�E�W�F�f�͐H�o�������\�N�ƒ�������܂Ō��N��Q�͕���Ă��܂���B
2�j�@�\���\���H�i���x�̉����u�@�\���\���H�i�����錟����v
���ѐ���̍g���T�v�������g�̌��N��Q���āA���̊W�t����c�ł͓����i���@�\���\���H�i���������Ƃ��琧�x���������߁A����Ғ���2024�N5�����܂Łu�@�\���\���H�i�����錟����v���S6��J�Â���܂����B3�����̋L�Ҕ��\����5�����ł�����2�J���قǂ�������܂���B�ٗ�̑����ł��B���������o�[�͈�t�A��t�A�w���ҁA�h�{�m�Ȃ�9���̐��Ƃō\���B5��27���ɂ͕����܂Ƃ߂��܂����B
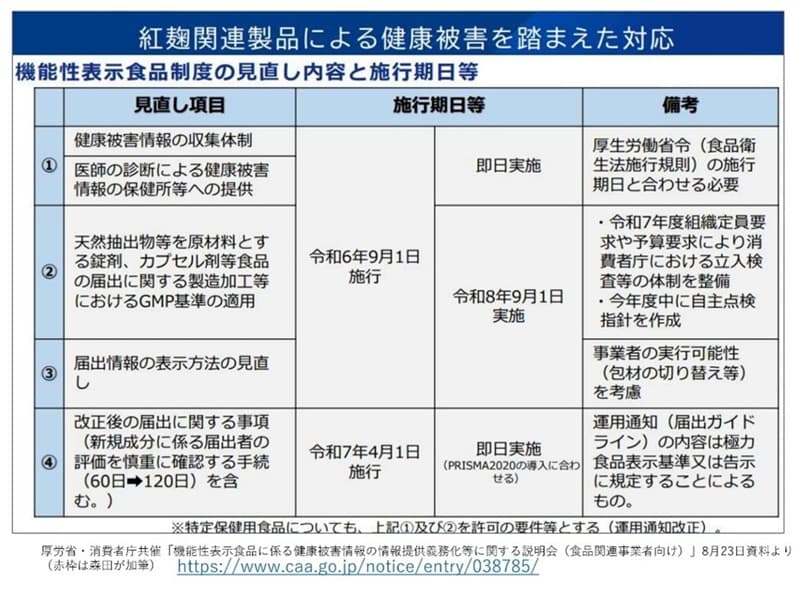
��������ł́u���N��Q�̏��̋`�����v�u�@�\���\���H�i��GMP�̗v�����v�u�\�����@�̌������v�����߁A������܂߂�����̑Ή����W�t����c�͉��L�̂Ƃ��蔭�\���܂����B
��������̎�ȃ|�C���g�͎���3�ł��B
�i1�j���N��Q�̏��̋`����
���ѐ���́A1���Ɉ�t������������ɂ�������炸�v���ɑΉ������܂���ł����B2���ɓ����āA�����̑�w�a�@����u���܂Ō��N�������̂ɐt���̌��N��Q�œ��@����Ă��鏗����3�l����B3�l�̋��ʓ_�͍g���̃T�v��������ł������Ƃ�����A�����悤�Ȍ��N��Q���o�Ă��Ȃ����v�Ɩ₢���킹�Ă��܂����A���Ђ͂Ȃ������Ɠ����Ă��܂��B���ѐ���͂��������\�����A���ЂŌ������������悤��3���܂ł������Ă��܂����B���̂悤�Ȃ��Ƃ��N���Ȃ��悤�ɁA����҂��猒�N��Q�̘A�������������t�̔��f�̂�����̓��������������̂́A�ی������̒n�������̂���я���Ғ��ɒ��ڕ��邱�Ƃ��`��������Ƃ�����������������܂����B
�i2�jGMP�i�K�������K�́j��v����
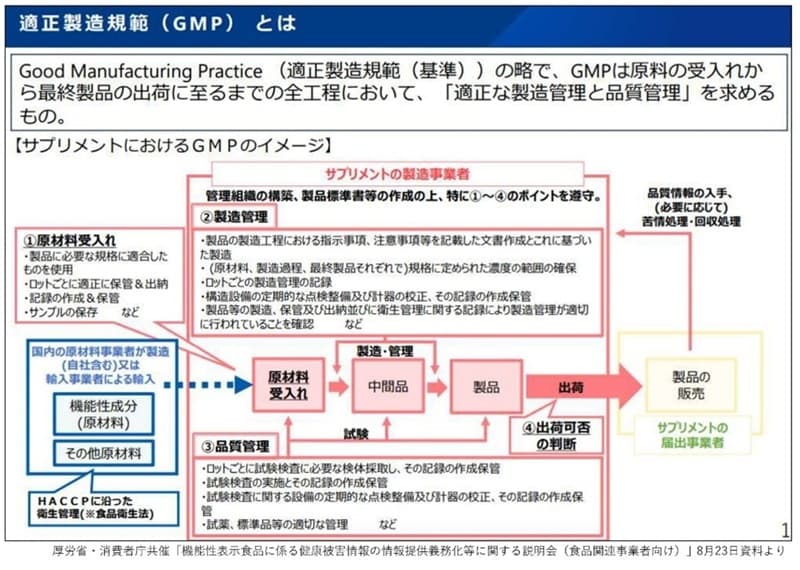
�T�v�������g�`��̉��H�H�i�ɂ��ẮA�����H��Ō���������Ă�����ܓ��ɂ���܂ł̑S�H���̕i���Ǘ��ƌ������Ō������Ǘ�����GMP�̐��x���`�������邱�ƂɂȂ�܂����B�T�v�������g�͔Z�k������Ė����ێ悷����̂ł�����A���i���̂̈��S�����m�ۂ��邱�Ƃ��K�v�ł��B���i�ł͊��ɋ`��������Ă���GMP�̍l������������̂ł��B
�i3�j�\���̕��@������̉��P
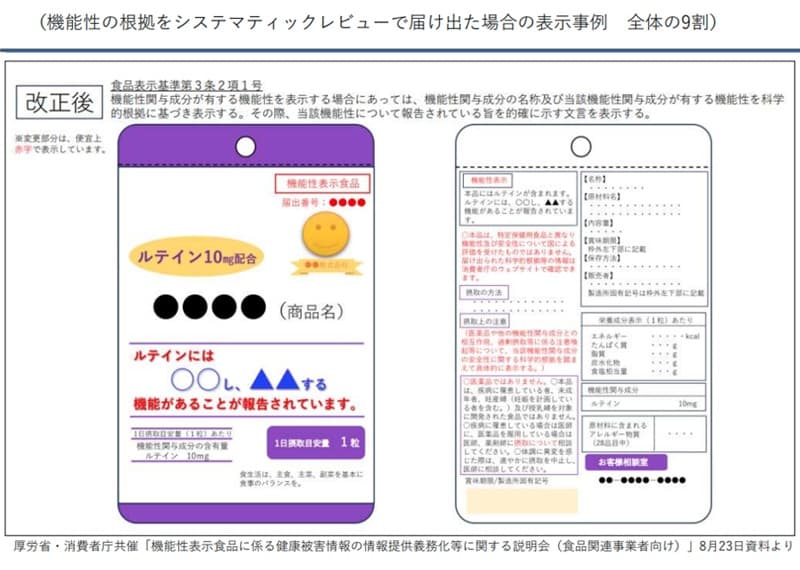
�O�q�̂悤�ɁA�g���́u���ʃR���X�e���[���l��������v�Ɠ͏o�\�����o���ĕ\�������Ă��܂������A����͌���������悤�ȕ\�����ł��Ȃ��悤�ɏ���Ғ��ɓ͏o����u�@�\���\���v��\�ʂɕ\������Ƃ��̃��[������������܂����B�܂��A�u���i�ł͂���܂���v�Ƃ����\�������߂��܂����B
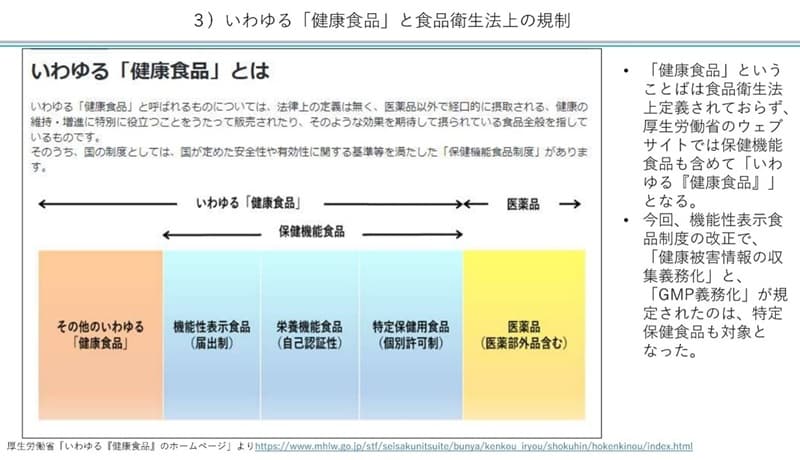
3�j������u���N�H�i�v�ƐH�i�q���@��̋K��
�Ƃ���ŁA�@�\���\���H�i�̘b�����Ă��܂������A����́g������u���N�H�i�v�h�̈�ł��B�g������u���N�H�i�v�h�Ƃ͋�̓I�ɉ����w���̂ł��傤���B���́u���N�H�i�v�Ƃ������t�͐H�i�q���@���`����Ă��炸�A�����J���Ȃ̃E�F�u�T�C�g�ł͕ی��@�\�H�i���܂߂āg������u���N�H�i�v�h�Ƃ���Ă��܂��B
���N�H�i�̂����A������߂����S����L�����Ɋւ��������������̂��u�ی��@�\�H�i�v�ƌĂ�ł��܂��i�ȉ��̐}���Q�Ɓj�B���̒��ɁA�@�\���\���H�i��h�{�@�\�H�i�A����ی��p�H�i�i�g�N�z�j���܂܂�Ă��܂��B
����̋@�\���\���H�i���x�̉����Łu���N��Q���̎��W�`�����v�ƁA�uGMP�`�����v���K�肳��܂������A�g�N�z�����̑ΏۂƂȂ��Ă��܂��B
�u���N�H�i�ɂ͉��̋K�����Ȃ��v�Ƃ悭������̂ł����A����Ȃ��Ƃ͂Ȃ��A�H�i�q���@��A�H�i�\���@�Ƃ����A���N�H�i�S�̂ɂ�����K��������܂��B
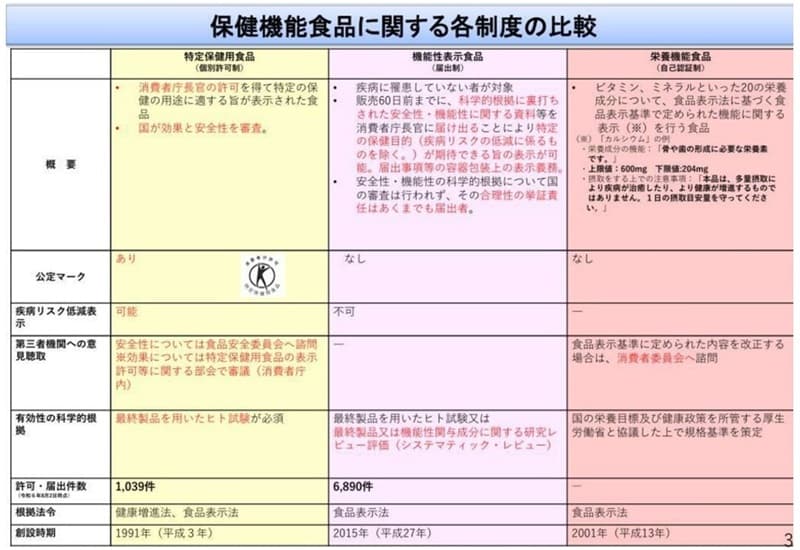
�ȉ��̕\�́A����Ғ���������Ŏ������ی����N�H�i�Ɋւ���e���x�̔�r�ł��B
��\�̈�ԍ��̃g�N�z�́A1991�N�ɐ��x���ł������R�����o�ĔF�߂�����̂ł��B�E�[�̉h�{�@�\�H�i��2001�N�ɐ��x���ł��A�r�^�~���E�~�l�����Ƃ�����20�̉h�{�����ɂ��āA�H�i�\���@�Ɋ�Â��H�i�\����Œ�߂�ꂽ�@�\�Ɋւ���\�����s���H�i�ł��B
�\�̐^�́A�@�\���\���H�i��2015�N�ɐ��x���ł��܂����B�@�\���\���H�i�́A�͂��o���ŁA���S����@�\���̉Ȋw�I�����ɂ��č��ɂ��R���͍s���Ȃ����߁A���Ǝ҂ɂƂ��Ă͕��S�����Ȃ��B�g�N�z�͍ŏI���i��p�����q�g�������K�{�ł����A�@�\���\���H�i�͋@�\���֗^�����̗L�����Ɋւ���_�������r���[����A���̐��i���̂��̂Ŏ������s��Ȃ��Ă����̋@�\�������i�ɕ\�����邱�Ƃ��ł��܂��B������Ƃł��Q�����₷���A���̌o�ϐ���Ƃ��ē������ꂽ���x�ł��B
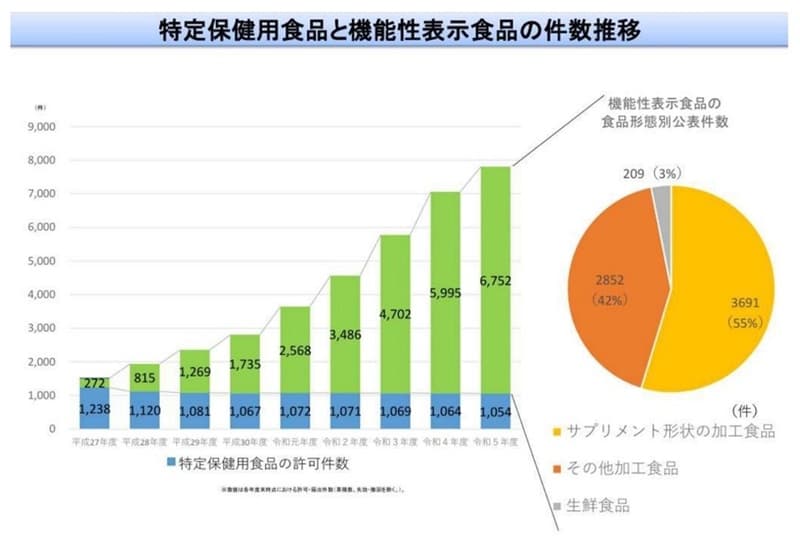
����10�N�Ńg�N�z�̐��͑����Ă��܂��@�\���\���H�i�̋����������������Ă���̂͂��������킯�Ȃ̂ł��i���\�j�B
���āA������u���N�H�i�v�̐ێ�ɂ���Č��N��Q���N����ƂƂǂ��Ȃ�̂ł��傤���B��Ԍ������̂́A�H�i�q���@��U���Ɋ�Â��̔��֎~�ł��B���Ƃ��Ήߋ��ɃR���t���[��A�}���V�o�Ƃ����H�i���̔��֎~�ɂȂ��Ă��܂��B
���S���Ⴊ�o��قǂł͂Ȃ����N��Q���o�鐻�i�́A�v�G�����A�E�~���t�B�J��������܂��������4�����́A2020�N6���̉����H�i�q���@�ɂ��w�萬�����ܗL�H�i�Ƃ��āA���Ǝ҂ɂ͌��N��Q���̕�GMP�̋`���������߂��܂����B�����āA����҂ɂ͐H�i�\���Œ��ӊ��N����邱�ƂɂȂ�܂����B
�����܁E�T�v�������g�`���GMP�ɌW��K��
����A����܂Ō����J���Ȃ͂�����u���N�H�i�v�̃T�v�������g�`��̈��S�m�ۂ̂��߂ɁA����17�N�Ɂu���ޗ��̈��S���m�ۂƐ����H���Ǘ��iGMP�j�ɂ��āv�̒ʒm���o���AGMP�⌒�N��Q�����W��w�߂�悤�ɁA�Ƃ��Ă��܂����B�����āA2024�N3��11���Ɂu���܁E�T�v�������g�`���GMP�ɌW��K���i�ȉ��A311�ʒm�ƕ\�L�j�v�\���A���ޗ��̈��S���̊m�ۂƁAGMP�i�����H���Ǘ��j�ɂ����S���̊m�ۂɓw�߂�悤�ɋ��߂Ă��܂��B
����311�ʒm�́A�g���֘A���i�̖����Ă����12���Ɉꕔ��������A311�ʒm�ł͌��y����Ă��Ȃ������|�{�Ȃǂ̊Ǘ��ɂ��Ă��A�ʎ��������܂����B
�@�\���\���H�i�̐��x����
��������́A�ŏ��ɂ��b�������g���֘A���i�����@�\���\���H�i���x�̉����ɖ߂��āA�݂Ă����܂��傤�B
�ȉ��́A���x�̌��������e�Ǝ{�s���������ꗗ�ɂ������̂ł��B
①���N��Q���̎��W�ɂ��ẮA�������{�ƂȂ��Ă��܂��B
②GMP�̋`�����A③�\�����@�̌������ɂ��ẮA�̐��̐����Ȃǂ����肢���Ȃ���{���邱�Ƃ͓���̂�2�N�Ԃ̗P�\���Ԃ�����܂��B
④�́A�V�K�������g�p�����@�\���H�i��͏o����ꍇ�́A���Ƃ̈ӌ������߂铙�T�d�Ɏ葱�������܂��傤�Ƃ������Ƃł��B�܂��C�ɂ��ẮA�@�\���Ɋւ���V�X�e�}�e�B�b�N���r���[�Ɋւ���uPRISMA2020�v�Ƃ������i��������@�̓��������܂��Ă����̂ŁA���̎{�s�ɍ��킹�ėߘa7�N4��1������{�s����܂��B
���x�����ɂ��ẮA����Ғ��̃E�F�u�T�C�g�ł��m�F���������B
1�j���N��Q�̏��̋`�����i�H�i�\���@�ƐH�i�q���@�̑Ή��j
�ȏ�̂Ƃ���A�@�\���\���̉����ɂ��Ă�2024�N9��1���ɐH�i�q���@�{�s�K���̉����A����ѐH�i�\����̉������{�s����܂����B����̉����ɂ���Č��N��Q�̏��̋`��������A�ᔽ�����ꍇ�͐H�i�q���@�Ɋ�Â��ĉc�Ƃ̋֎~�E��~�̍s�����u���\�ƂȂ�܂��B�܂��A�@�\���\�����s���Ȃ��悤�ɂȂ�܂��B
�ȉ��́A���N��Q���̎��W���̗����}���������̂ł��B
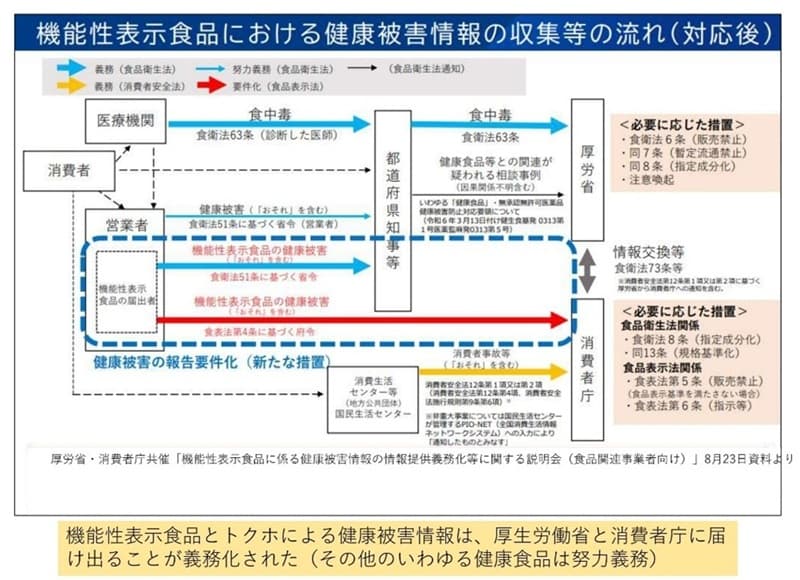
���N��Q�̏��ɂ́A��҂̐f�f���K�v�ł��B����҂���҂ɂ������Ĉ�t���玖�Ǝ҂ɕ��A���̓��e�����ƂɎ��Ǝ҂͓s���{���m���Ə���Ғ��ɕ��܂��B
����҂���݂�ƁA�̒��s�ǂ����Ǝ҂ɘA�����Ă���҂���Ȃ���Ȃ�Ȃ��̂ŁA����҂���̕��オ���Ă��Ȃ��̂ł͂Ǝ��͐S�z�����̂ł����A�ی����ւ̑��k����͑����Ă��邻���ō��̂Ƃ���͏d�ĂȂ��̂͂Ȃ��A�{���x�͋@�\���n�߂Ă���悤�ł��B
����҂���݂�ƁA��҂ɂ�����Ȃ��Ă����N��Q�𑊒k�ł�����@������܂��B����́u188�v�ɓd�b���邱�Ƃł��B188����Ŋ��̏�����Z���^�[�ɂȂ���APIO-Net�Ƃ����V�X�e���ɏ���͂���A���N��Q���Ƃ��Ď��W����܂��B���ꂪ�@�\�����̂��A�O�q�̎w�萬�����ܗL�H�i���x�ł��B
2�j�T�v�������g��GMP�̋`����
�@�\���\���H�i�̒��ł��T�v�������g�`��i���܁j�ɂȂ��Ă��鐻�i�ɂ��āA�T�v�������g�̐������Ǝ҂�GMP�i�K�������K�́j���`��������܂����B
GMP�ɂ����ẮA�Ǘ��g�D�̍\�z�A���i�W�������̍쐬�̏�A�ȉ��̐}��①�`④�̊Ǘ��O�ꂪ���߂��܂��B
①�͌��ޗ��̎���ł��B���S�Ȃ��̂��g�p���邾���łȂ��A���b�g���ƂɓK���ɕۊǁA�L�^�̍쐬�ƕۑ��A�T���v���̕ۑ��Ȃǂ����߂��܂��B
②�͐����Ǘ��ł��B�����H���ł̉q���Ǘ��A�����H���ɂ�����w�������̕������A���b�g���Ƃ̐����Ǘ��Ȃǂ����߂��܂��B
③�͕i���Ǘ��ł��B�u���ޗ��̎���v���u���ԕi�v���u���i�v�̍H�����Ƃɕi�����`�F�b�N�����������̎��{�ƋL�^�̍쐬�ۊǂ��K�v�ƂȂ�܂��B
④�͏o�ۂ̔��f�ł��B�ŏI�I�Ȑ��i�����������̂����`�F�b�N�����̂��ɂ悤�₭�o�ׂ��ł���Ƃ������Ƃł��B
GMP���`�����ƂȂ�Ɣ�p�Ȃǂ�������܂����A����Ғ��̗������蒲��������̂Ŏ��Ə��̕��S���傫���Ȃ�܂��B
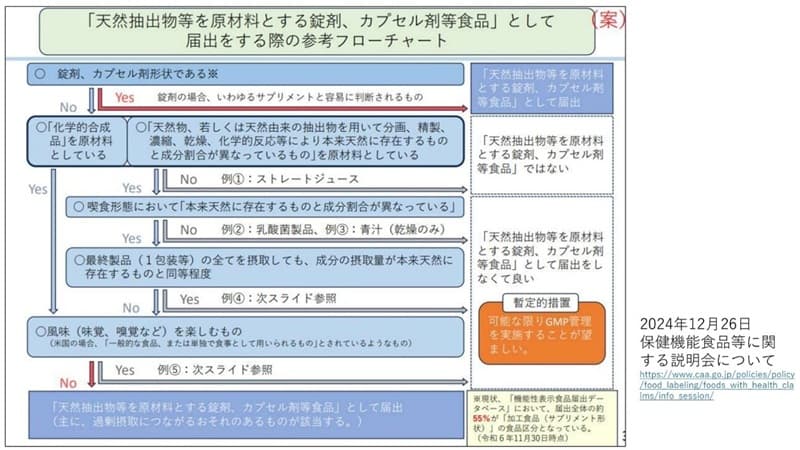
�ł�����A�T�v�������g�ɊY�����邩�ǂ����́A���Ǝ҂ɂƂ��Ă͏d��Ȗ��ł��B���Ƃ��Ώ��ق�O�~��̂��̂͏��܂ɂȂ�̂��A�Z�k�W���[�X�͂ǂ��������Ǝ҂���̎��₪���������̂ŁA����Ғ��͎��ƎҌ����ɐ�������J�Â��Ă��܂��B�ȉ��́A���܁E�J�v�Z���ܓ��H�i�ɊY�����邩�ǂ����f���邽�߂̃t���[�`���[�g�ł��B
3�j�͏o���̕\�����@�̌�����
���@�\���\���H�i�̕\����
����̉����ł́A�@�\���\���H�i�̕\�����x����������܂����B���L�̐Ԏ��̕������������ꂽ���̂ŁA���݂̋@�\���\���H�i�S�̂�9�����߂�V�X�e�}�e�B�b�N���r���[�ɂ��͏o�̕\����ł��B
������ł́u�R���X�e���[����������v�ȂǓ͏o�\���̔����������������Ƃ͂ł��܂���B�u���̐��i�Ɋ܂܂�遜���ɂ́A�����̋@�\�����邱�Ƃ�����Ă��܂��v�̂悤�ɕ\�ʂɂ��\�����܂��B�H�i���̂Ɍ��ʂ�����ƌ�������悤�ȕ\�L�͂ł��܂���B
�܂��A�u�{�i�͈��i�ł͂���܂���v�Ɩ��L���邱�Ƃ�A���Ƃ��A�u�{�i�ɂ���Ď��a���������邱�Ƃ͂���܂���v�̂悤�ɁA���i�ł͂Ȃ����ƂL����K�v������܂��B
�܂��A�ێ�������ł̒��ӎ������L�ڂ��Ȃ���Ȃ�܂���B���N�H�i�͈��i�Ƒ��ݍ�p��������̂������A���Ƃ��A�C�`���E�t�̃T�v�������g�����ނƁA���t���T���T���ɂ��郏�[�t�@�����Ƃ��������Ȃ��Ȃ邱�Ƃ�����܂��B���i�p���Ă���҂͈�t�A��t�ɐێ�ɂ��đ��k���ׂ����Ƃ�\������K�v������܂��B
���̑��A�H�i�\���ɂ��čׂ����w��������̂ŏ���Ғ��̃E�F�u�T�C�g�Ŋm�F���Ă����܂��傤�B
4�j���̑��E������̓͂��o�Ɋւ��鎖��
����܂ŋ@�\���\���H�i�Ƃ��ē͏o����Ă��Ȃ��V�K�����ɂ��Ă͂��T�d�Ɋm�F���邽�߂ɁA�͏o����120���ȓ��ɐ��Ƃ���ӌ����d�g�݂��V���ɓ�������܂����B
�܂��A������ɂ���������߂��A���S������ы@�\���̍����Ɋւ��鎖���A���Y�E��������ѕi���̊Ǘ��Ɋւ��鎖���ɂ��āA�N1����Ȃ���Ȃ�Ȃ����Ƃ��ʕ\27�ɋL����܂����B
���Ƃ��Δ�����ɐV�����_�����o�āA�@�\���Ɋւ��鍪�����ς�����肵�Ă��Ȃ����A���i�̕i�����ς���Ă��Ȃ������A���ɍׂ����`�F�b�N���ڂɂ��Ė��N�m�F���ĕ��Ȃ���Ȃ�܂���B�����܂łɕ����o���Ȃ���A�@�\���\���H�i�ƕ\���ł��Ȃ��Ȃ�܂��B
����̉����ɂ���ă��[�������i������@�\���\���H�i�̓͏o�̃n�[�h�����オ��܂��B�V�K�̋@�\���\���H�i�͓͏o������Ȃ邩������܂���B
5�j�܂Ƃ�
2024�N3���̏��ѐ���̍g�����́A�������ɐ[���Ɏ~�߁A�@���x�̉������s���A���N��Q�̏����`��������A�T�v�������g�`��̉��H�H�i�ɂ��Ă�GMP���`��������܂����B�g�N�z�����̂Q���`��������܂����B�܂��A�\�����@���������Ȃ�܂����B
���ꂾ���̐��x�����N�ōs�����̂́A�g�������̉e�����ǂ�قǑ傫���������������Ă��܂��B
�@�\���\���H�i�͋��U�֑�L����A�@�\���̍����̐Ǝコ�Ȃǂ����ɂȂ��Ă��܂������A����͈��S���ɂ��đ啝�ɋK������������邱�ƂɂȂ�܂����B
����A���N�H�i�͂ǂ��Ȃ�̂ł��傤���B
����҈ψ���E����ψ����́A2024�N7��16���̋L�҉�ŁA�u�@�\���\���H�i�̉����Ă͓K���ł���v�Ƃ����u�l�X�ȉۑ肪�c���Ă���v�Əq�ׂĂ��܂��B�ی��@�\�H�i�ȊO�ɂ������錒�N�H�i�ɂ��T�v�������g�͑�������A�����͌��N��Q�����W���x��f�l�o���`���t�����Ă��Ȃ����Ƃ���A�u�T�v�������g�H�i�ɌW�����Җ��͏d�v�����ł���ƔF�����Ă���A����������R�c���s���Ă܂���܂��v�Əq�ׂĂ��܂��B
�Ƃ���ŁA�C�O�̌��N�H�i���x�͓��{��肩�Ȃ茵�����A���Ƃ��Ή��B�ł́A�m�[�x���t�[�h�iNovel Food�F�V�K�H�i�j�Ƃ������x������A�H�o���������Ԃ�����̂łȂ���Ό����Ƃ��ė��ʂ����邱�Ƃ͂ł��܂���B�����錒�N�H�i��EU���ŐV���ɔ̔�����ɂ́A���B�H�i���S�@��(EFSA�j�̃��X�N�]���ȂǁA�l�X�ȐR�����K�v�ł��B
�č��ł́A�T�v�������g�̂��߂̖@���i�_�C�G�^���[�T�v�������g����@�j������A�V�K�����͒����H�o�����K�v�ł��B�܂��A���N��Q���̓͏o��GMP�����ɋ`���t�����Ă��܂��B
���{�̃T�v�������g�Ɋւ���K���͉��ĂƔ�r����Ɗɂ��A������u���N�H�i�v�̈��S���m�ۂ�����̉ۑ�ƂȂ�ł��傤�B